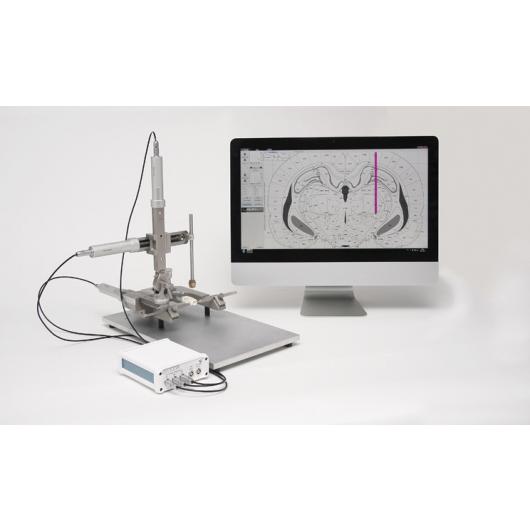
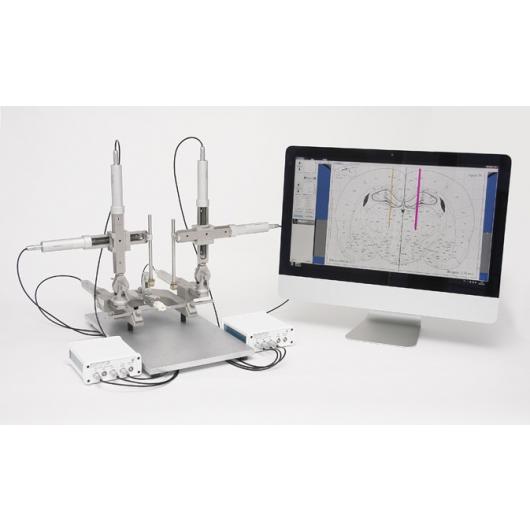
Stereotaktický robot Robot Stereotaxic – StereoDrive
Plně motorizovaný stereotaktický nástroj pro potkany, myši i větší zvířata. Obsahuje software s digitálním atlasem mozku a lokací bregmatu. Počítačově řízená korekce náklonu hlavy a nastavení úhlu. Přesnost 1 mikron.
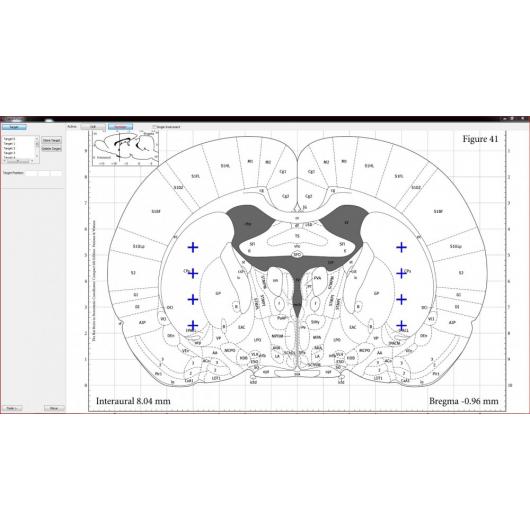
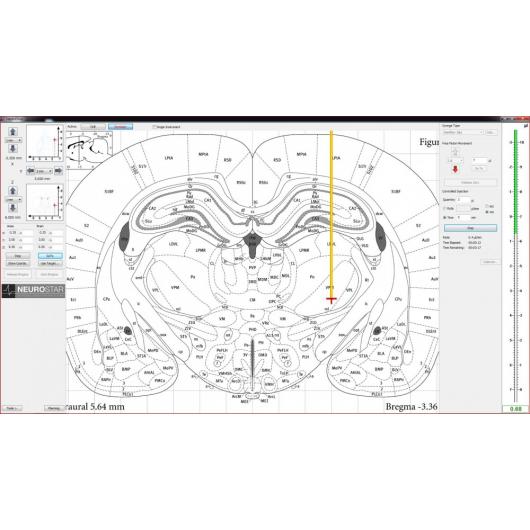
Neurostar je vynálezcem i jediným výrobcem stereotaktického robota Robot Stereotaxic – StereoDrive. Při práci s tímto rámem se můžete soustředit na pokus bez nutnosti manipulace s přístrojem. Nastavení sondy je u StereoDrive motorizované a navigované počítačem. Integrovaný atlas mozku (Atlas Integration) a intuitivní řízení pohybu přináší vysokou přesnost a vysokou propustnost elektrofyziologických a stereotaktických injekcí.
Funkce
|
|
Eliminace běžných nevýhod
- Jednou z vynikajících předností stereotaktického robota StereoDrive je skutečnost, že při jeho použití nemusíte věnovat svou pozornost konverzi koordinátů rámu na koordináty atlasu. Soustředíte se pouze na atlas – všechny potřebné výpočty za vás provede software.
- StereoDrive dosahuje nebývale vysoké přesnosti polohování nedosažitelné u manuálních stereotaktických přístrojů či přístrojů s digitálním odečtem.
- U přístroje StereoDrive je zaměření sondy prováděno počítačově, čímž se vyloučí vibrace způsobené pohybem rukou.
Vlastníte stereotaktický přístroj od Kopfa nebo Stoeltinga?
Upgadujte na Robot Stereotaxic od Neurostar.
Stereotaktický robot od Neurostar nabízí uzpůsobení robota pro U-rám, který používáte.
Více
2013
Prefrontal Activity Links Nonoverlapping Events in Memory.
Gilmartin, M. R., Miyawaki, H., Helmstetter, F. J., & Diba, K. (2013)
The Journal of Neuroscience, 33(26), 10910-10914.
Babaei, P., Tehrani, B. S., & Alizadeh, A. (2013)
Journal of Behavioral and Brain Science, 3, 156-161.
Subcortical effects of transcranial direct current stimulation (tDCS) in the rat.
Bolzoni, F., Bączyk, M., & Jankowska, E. (2013)
J. Physiol. 2013 Aug 15;591(Pt 16):4027-42. doi: 10.1113/jphysiol.2013.257063. Epub 2013 Jun 17.
Bell, L. A., Bell, K. A., & McQuiston, A. R. (2013)
Neuropharmacology. 2013 Oct;73:160-73. doi: 10.1016/j.neuropharm.2013.05.026. Epub 2013 Jun 5.
Ali, I., O’Brien, P., Kumar, G., Zheng, T., Jones, N. C., Pinault, D., O’Brien, T. J. (2013).
PLOS ONE, 8(6), e66962.
The toxicity of antiprion antibodies is mediated by the flexible tail of the prion protein.
Sonati, T., Reimann, R. R., Falsig, J., Baral, P. K., O’Connor, T., Hornemann, S., Aguzzi, A. (2013)
Nature, 501(7465), 102-106.
Albéri, L., Lintas, A., Kretz, R., Schwaller, B., & Villa, A. E. (2013)
Journal of Neurophysiology, 109(11), 2827-2841.
2012
Clarner, T., Diederichs, F., Berger, K., Denecke, B., Gan, L., Van der Valk, P., Kipp, M. (2012).
Glia, 60(10), 1468-1480.
Feng, L., Sametsky, E. A., Gusev, A. G., & Uteshev, V. V. (2012)
Journal of Neurophysiology, 108(7), 1884-1894.
2011
Girardet, C., Bonnet, M. S., Jdir, R., Sadoud, M., Thirion, S., Tardivel, C., Troadec, J. D. (2011)
Toxicological Sciences, 124(1), 179-191.
2010
A26 Transgenic miniature pig as an animal model for Huntington’s disease.
Baxa, M., Juhas, S., Pavlok, A., Vodicka, P., Juhasova, J., Hruška-Plocháň, M., Motlik, J. (2010).
Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A8-A9
Yu, L., Metzger, S., Clemens, L. E., Ehrismann, J., Ott, T., Gu, X., Nguyen, H. P. (2010).
Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.
Brooks, S., Jones, L., & Dunnett, S. B. (2010). A29
Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A10.
Hruška-Plocháň, M., Juhas, S., Juhasova, J., Galik, J., Miyanohara, A., Marsala, M., Motlik, J. (2010).
Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.